Materi
adalah segala
sesuatu yang memiliki massa dan menempati ruang. Keberadaan materi dapat
diketahui dengan menggunakan indra.
Setiap
materi memiliki sifat-sifat atau karakteristik yang khas. Contoh, garam dapur
dan gula sama-sama merupakan padatan berwarna putih, tetapi gula berasa manis
dan jika dipanaskan akan berubah warna menjadi kecoklatan, sedangkangaram dapur
memiliki rasa asin dan jika dipanaskan akan meleleh.
Sifat
materi dapat digolongkan ke dalam sifat fisik dan sifat kimia. Sifat
fisik adalah sifat yang menggambarkan keadaan fisik materi yang meliputi
warna, bau, titik didih, titik leleh, titik beku dan lain-lain. Sifat
kimia adalah sifat zat yang berhubungan dengan perubahan kimia dan
energi yang menyertainya. Contoh,
kemudahan terbakar, kemudahan berkarat, kemudahan reaksi dan lain-lain.
Materi
digolongkan dalam 3 wujud, yaitu padat, cair dan gas. Materi yang berwujud
padat memiliki bentuk dan volume tetap. Materi yang berwujud cair memiliki
bentuk bergantung pada wadah yang ditempatinya, tetapi memiliki volume tetap.
Materi yang berwujud gas memiliki bentuk dan volume yang tidak tetap.
KLASIFIKASI MATERI

1.
UNSUR
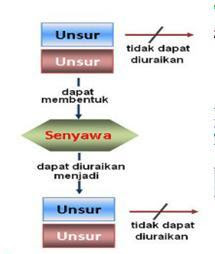
Unsur adalah
zat tunggal yang tidak dapat diuraikan lagi menjadi zat-zat lain yang lebih
sederhana dengan reaksi kimia biasa. Contoh Unsur dalam kehidupan sehari-hari :
Arang yang berwarna hitam, yang terdapat dalam sisa pembakaran, dalam pensil
dan digunakan sebagai elektroda dalam batere, adalah unsur karbon. Unsur
Logam juga dapat
kita jumpai dalam bentuk perhiasan emas, perak dan platina. Contoh unsur logam
cadmium, air raksa dan timah hitam.
§
JENIS UNSUR
§ Dibedakan
menjadi unsur
logam dan unsur bukan logam.
§ Unsur
logam mudah dikenali dengan ciri-ciri; permukaannya mengkilat, berbentuk padat,
kecuali air raksa (Hg) yang berbentuk cair. Unsur logam
mudah ditempa dapat menjadi plat atau kawat dan memiliki kemampuan menghantar
arus listrik atau konduktor.
2.
SENYAWA
Zat tunggal berupa senyawa didefinisikan sebagai zat yang dibentuk dari berbagai jenis unsur
yang saling terikat secara kimia dan memiliki komposisi yang tetap. Senyawa
terdiri dari beberapa unsur, maka senyawa dapat diuraikan menjadi
unsur-unsurnya dengan proses tertentu.
Contoh senyawa yang paling mudah kita kenal adalah air. Senyawa air
diberi lambang H2O.
Pengelompokan Senyawa

Ø Senyawa organik dibangun oleh
atom utamanya karbon, sehingga senyawa ini juga dikenal dengan istilah hidrokarbon. Senyawa hidrokarbon banyak terdapat di alam
dan juga pada makhluk hidup, dimulai dari bahan bakar sampai dengan molekul yang berasal atau
ditemukan dalam makhluk hidup Contohnya seperti
karbohidrat, protein, lemak, asam amino dan ureum atau urea terdapat pada air
seni (urin). Gula pasir atau sakarosa yang banyak terdapat didalam tebu dan
alkohol merupakan hasil fermentasi dari lautan gula, dll.
Ø Senyawa Anorganik
Senyawa
Anorganik adalah senyawa-senyawa yang tidak
disusun dari atom karbon, contoh senyawa ini seperti garam dapur (NaCl), alumunium hidroksida yang dijumpai pada obat
mag, (Al(OH)3).
Ø Senyawa oksida
Senyawa
oksida dibentuk
oleh atom oksigen dengan atom lainnya. atom oksigen sebagai penciri senyawa
oksida. Dibedakan menjadi dua macam, yaitu senyawa oksida logam
dan oksida bukan logam.
Ø Senyawa asam, = senyawa yang masam, dapat
menghantarkan arus listrik, dalam bentuk cair terionisasi dan menghasilkan ion
hidrogen (H+ ) dan
ion sisa asam.
Terdapat tiga jenis asam:
a.
dibentuk oleh unsur H, unsur bukan logam dan unsur O, contoh Asam Fospat H3PO4
dan asam nitrat HNO3.
b.
dibentuk oleh unsur H dengan unsur halogen lebih
dikenal dengan asam halida,
contoh Asam klorida HCl.
c.
yang ketiga asam pada senyawa organik yang
disebut dengan karboksilat,
contoh asam asetat atau asam cuka CH3COOH.
Ø Senyawa basa, dibentuk oleh unsur logam dan dengan gugus
hidroksida (OH). Senyawa basa
terasa pahit atau getir jika dirasakan, menimbulkan rasa gatal panas.
Ø Senyawa garam = dibentuk oleh unsur logam dan
sisa asam. memiliki rasa asin, larutan senyawa ini dapat menghantarkan arus
listrik kerena terjadi ionisasi. Senyawa garam NaCl, terionisasi menjadi ion
Na+ dan ion sisa asam Cl.
MOLEKUL SENYAWA DAN MOLEKUL UNSUR

Senyawa
yang disusun oleh satu unsur disebut dengan molekul unsur, ditunjukkan oleh senyawa diatomik seperti senyawa H2,
dan O2. molekul gas oksigen (O2) terdiri atas dua atom
oksigen.
Senyawa
yang disusun oleh beberapa unsur, bagian terkecil disebut dengan molekul senyawa, molekul semacam ini ditemui
pada senyawa heteroatomik, seperti H2O,
dan P2O5, N2O3.
3.
CAMPURAN
Campuran
adalah materi yang disusun oleh beberapa zat tunggal baik berupa unsur atau
senyawa dengan komposisi yang tidak tetap. Dalam campuran sifat dari materi
penyusunnya tidak berubah.
MEMBEDAKAN CAMPURAN DAN SENYAWA
Campuran
|
Senyawa
|
a.
Campuran
tak tertentu tanpa reaksi kimia.
b.
Perbandingan
komponen yang menyusun campuran tidak tentu dan dapat sembarang.
c.
Komponen-komponen campuran tetap memiliki sifat masing-masing.
d. Campuran dapat dipisahkan
menjadi komponen-komponennya dengan cara fisis
|
a. Senyawa terbentuk melalui reaksi kimia
b. Perbandingan komponen yang menyusun senyawa
melalui cara tertentu
dan tetap.
c. Komponen-komponen senyawa kehilangan sifat
semulanya.
d. Senyawa tidak dapat
dipisahkan menjadi komponen-komponen dengan
cara fisis, tetapi harus melalui cara reaksi kimia
|
Tidak ada komentar:
Posting Komentar